| Imagen de |
Queridos lectores,
Al hilo de una discusión en Facebook sobre el los riesgos asociados al accidente de Fukushima, Luis Cosin se ha ofrecido a escribir un post técnico acerca de la radiactividad y la radiación.
Les dejo en buenas manos, las de Luis.
Salu2,
AMT
Introducción
La
radiactividad ha adquirido gran protagonismo en los medios de
comunicación a partir de los incidentes ocurridos en Fukushima.
La
radiación es, sin embargo, un fenómeno natural, aunque la
tecnología esta creando nuevas fuentes de radiación más intensas y
peligrosas que las naturales.
En
este ensayo, pretendo dar una visión general del fenómeno, la forma
de medirlo y sus efectos sobre la salud:
- Radiactividad, radiación ionizante, radiactivo ... ¿de qué estamos hablando?
- Orígenes: ¿De dónde procede?
- ¿Cómo interacciona con la materia y qué efectos tiene sobre la salud?
Espero
que sea del interés del lector.
1.
Radiactividad, radiación ionizante, radiactivo ... ¿de qué estamos
hablando?
1.1.
Descubrimiento
La
radiactividad es el fenómeno físico por el cual ciertos
cuerpos emiten radiación ionizante, es decir, radiación que
es capaz de “barrer”, absorber o expulsar los electrones de
átomos y moléculas a su alrededor.
Señalización
típica que indica la presencia de radiación ionizante
Dado
que los electrones son el “cemento” que mantiene unidas
las moléculas, la radiación ionizante tiene la capacidad de
desestabilizar y romper dichas moléculas.
Hay
que distinguirla de muchos otros muchos tipos de radiación: luz,
microondas, radio...etc. que no tienen esta capacidad.
La
radiactividad fue descubierta casualmente por Henri Becquerel en
1896, observando que las placas fotográficas que permanecían cerca
de piezas del mineral Pechblenda (que contiene Uranio) se
velaban aunque no les diese la luz.
Fuentes:
- Tipos de radiactividad
Marie
Curie y su esposo investigaron este fenómeno, estudiando diversos
minerales, y descubrieron que otras sustancias, como el Torio (Th) y
el Radio (Ra), tenían el mismo efecto, al que denominaron
genéricamente “radio-actividad” (literalmente “actividad
del Radio”).
El
Radio (Ra) es un emisor extremadamente fuerte de radiación y
muchos pioneros padecieron enfermedades causadas por la exposición
prolongada a la misma.
Midiendo la energía transportada por
esta radiación y sometiéndola a campos eléctricos y magnéticos
y observando su comportamiento (mediante varios experimentos
diseñados por Rutherford) se llegó a la conclusión que la
radiactividad tenía origen en transformaciones que ocurrían en los
núcleos de los átomos y consistía esencialmente en tres
fenómenos diferentes asociados a transiciones o cambios
nucleares (a los que se sumaría un cuarto en los años 30
del siglo pasado).
Los
experimentos de Rutherford consistieron en someter la radiación a
campos electromagnéticos y observar el desplazamiento que
producían en las partículas:
La
composición de la radiación ionizante, con el conocimiento actual
de la materia, consiste en:
- Partículas (radiación alfa): Es un flujo de partículas compuestas por dos neutrones y dos protones (núcleos de helio, He) a velocidades próximas a la de la luz. Son poco penetrantes, debido a su gran masa y carga eléctrica (son capturadas por las nubes de electrones que rodean a la materia), pero muy ionizantes, ya que el Helio es un gas noble extremadamente estable y su núcleo, una vez desprovisto de electrones, es extremadamente electrófilo.
Este
tipo de radiación es emitida por la descomposición de núcleos
atómicos muy pesados (número atómico A > 84,
correspondiente al Polonio, Po), que tienen muchos protones y están
sometidos a una tensión electrostática muy fuerte.
Liberando
carga eléctrica del núcleo, se transforman en átomos más ligeros
y estables.
El
núcleo de Helio es extremadamente estable y es uno de los
“ladrillos” con los que se construyen los núcleos más
pesados en el interior de las estrellas (en general, los átomos
con número par de protones y neutrones, es decir, que se han
formado por agregación de núcleos de Helio, son más estables y
abundantes en la naturaleza que los que tienen un número impar).
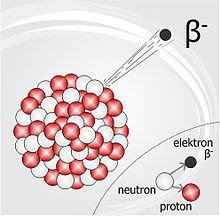
- Desintegración beta: Es un flujo de electrones (beta negativas) o positrones (beta positivas) resultante de la desintegración de las partículas elementales (neutrones o protones) de núcleos más pequeños cuando éstos se encuentran en un estado excitado o bien existe un exceso de tensión electrostática.
Existen
tres tipos de radiación beta:
- Beta-, que consiste en la emisión espontánea de electrones por parte de los núcleos (un neutrón se transforma en un protón).
- Beta+, en la que un protón del núcleo se desintegra y da lugar a un neutrón, a un positrón y un neutrino.
- Y la captura electrónica que se da en núcleos con exceso de protones, en la cual el núcleo captura un electrón de la corteza electrónica, que se unirá a un protón del núcleo para dar un neutrón.
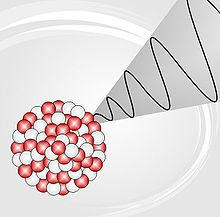
- Radiación gamma: Consistente en radiación electromagnética (fotones de luz) de muy alta energía (con longitudes de onda inferiores a 10-11 m). Por ser ondas electromagnéticas de gran energía, tienen gran capacidad de penetración en la materia.
Ocurre
cuando el núcleo se desprende de una cantidad de energía
para pasar a otro estado energético más bajo o menos excitado. La
cantidad de energía emitida por un fotón gamma es hν
(donde "h" es la constante de Planck y "ν" es la
frecuencia de la radiación emitida).
La
radiación gamma suele acompañar a las emisiones alfa y beta
y responde a las transiciones energéticas que no implican
modificaciones en la carga del núcleo.
- Neutrones: La radiación de neutrones (o “haz de neutrones”) y el neutrón en sí, fueron descubiertos en la década de 1930 a través de experimentos llevados a cabo por James Chadwick, Walter Bothe y Herbert Becker, y otros.
La
radiación de neutrones se consiguió por primera vez bombardeando
Berilio (Be) con partículas alfa y observando que se producía una
radiación que era absorbida por los núcleos de otros materiales,
convirtiéndolos en radiactivos.
La
mayoría de los materiales radiactivos producidos durante la
explosión de una bomba nuclear es creada de esta manera.
Fuentes:
1.3.
Transiciones nucleares productoras de radiación
El
tipo de transición nuclear al que es propenso un núcleo
depende del número de protones, Z, (también llamado
número atómico) y el número total de partículas, A,
(electrones y neutrones, llamado número másico).
Recordar
que dos átomos que tengan el mismo número de protones Z,
pero diferente número de partículas A, tienen las mismas
propiedades químicas y por ello ocupan la misma posición en la
tabla periódica (por eso se denominan isótopos (de
“iso+topos” mismo lugar). Los isótopos que emiten radiación se
denominan radioisótopos.
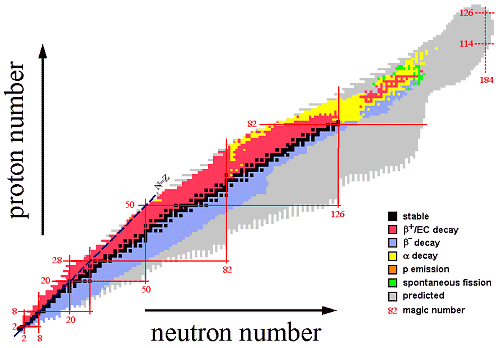
Esto
se intenta expresar gráficamente en lo que se conoce como tabla
de núclidos:
1.4. Periodo de semidesintegración
La desintegración de un núcleo o su transición
entre dos niveles de energía es un fenómeno estocástico,
que se da aleatoriamente con una cierta probabilidad.
A
mayor probabilidad, mayor número de desintegraciones
por unidad de tiempo (la unidad del sistema internacional para
esto es el Becquerel, Bq, correspondiente a una descomposición
por segundo).
El
número de desintegraciones sigue una ley exponencial inversa.
Es decir, el número de desintegraciones por segundo es proporcional
a la cantidad de átomos presentes en cada momento.
En
términos macroscópicos, se habla de tiempo medio de
semidesintegración, T1/2, que es el tiempo que
tardará en desintegrarse la mitad de los átomos de una muestra.
Los átomos estables son aquellos con largos periodos de
semidesintegración (superiores a varios miles de millones de años).
Por ejemplo, si un isótopo tiene un periodo de
semidesintegración de 1 año:
- Al cabo de 1 año, quedará sólo un 50% de la cantidad inicial de dicho isótopo.
- Al cabo de 2 años, quedará sólo un 25% de la cantidad inicial de dicho isótopo.
- Al cabo de 10 años, quedará sólo un 0,1% de la cantidad inicial de dicho isótopo.
...etc.
En el
siguiente gráfico se puede apreciar el periodo se semidesintegración
de los isótopos conocidos.
Son
remarcables los “huecos” existentes para Z = 43 (Tecnecio, Tc) y
Z entre 84 (Polonio, Po) y 89 (Actinio, Ac), donde no existen
isótopos estables. Tampoco se conocen isótopos estables, con
semividas superiores a unos pocos minutos, para Z mayor que 96
(Curio, Cm).
Fuentes:
2.
Orígenes: ¿De dónde procede?
Según
hemos visto, la radiactividad es una radiación ionizante que
procede de la desintegración o el cambio energético
dentro de núcleos atómicos inestables.
Cada
isótopo tiene un periodo de semidesintegración característico,
que va desde picosegundos (10-12 segundos) hasta varios
miles de millones de años.
Además,
la Tierra está “bañada” por la radiación de alta energía
procedente del cosmos. Es lo que se conoce como “radiación
cósmica”.
Y
el ser humano ha generado fuentes de radiación artificial.
Así, podemos clasificar las fuentes
de radiación en cuatro grandes tipos:
- Radiación cósmica
- Radioisótopos pesados
- Radioisótopos ligeros o inducidos
- Radiación artificial
2.1.
Radiación cósmica
Se
conoce como radiación cósmica primaria a la que se origina
en el espacio exterior por medio de procesos que liberan gran
energía en un tiempo breve (energía residual del Big Bang,
explosiones de supernova cercanas, erupciones solares...etc) y llega
a nosotros.
Está
constituida principalmente por partículas cargadas (protones,
electrones y partículas alfa) con energía muy elevada, viajando
casi a la velocidad de la luz.
Al
pasar por nuestra atmósfera, originan toda una serie de fenómenos
en cascada que tienen como consecuencia la producción de radiación
gamma y otras partículas, lo que se conoce como radiación
cósmica secundaria.
Los
pasajeros de un avión intercontinental que vuele a 10.000 m de
altitud, por ejemplo, están expuestos a una dosis de radiación
50 veces más alta que la presente al nivel del mar.
Fuentes:
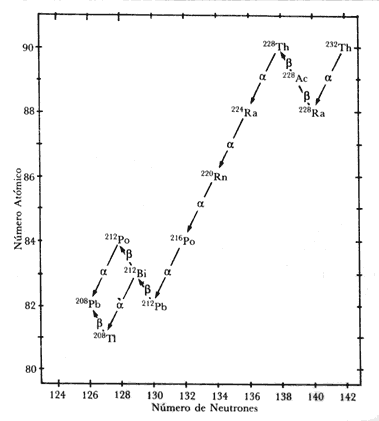
2.2. Radioisótopos pesados: las series del Uranio y el Torio
Otra
fuente de radiactividad natural son los isótopos radiactivos
pesados (más pesados que el Hierro, Fe, de número atómico
Z=26). Sabemos que se forman únicamente en eventos muy especiales
que ocurren sólo de vez en cuando: las explosiones de supernova.
El
hecho que en nuestro planeta existan isótopos pesados indica que
parte del material que lo forma proviene de una zona de la galaxia en
la que se ha dado este fenómeno.
La formación de nuestro planeta tuvo
lugar aproximadamente hace 4.000 millones de años. Sólo
algunos isótopos radiactivos tienen periodos de semidesintegración
de esta magnitud.
Esencialmente
todos los isótopos radiactivos de los elementos pesados
presentes de forma natural en nuestro planeta son producto de la
lenta descomposición del Uranio y el Torio, en lo que se
denomina series de desintegración, y están presentes en los
minerales de U y Th.
Uranio
Torio
- Serie de desintegración del Uranio-238 (238U, vida media de 4.500 millones de años):
- Serie de desintegración del Torio-232 (232Th, vida media de 14.000 millones de años):
- Serie de desintegración del Uranio-235 (235U, vida media de 700 millones de años):
Los
radioisótopos pesados más abundantes en nuestro planeta son:
Torio
232 >14.00 · 109 años
Uranio
238 4,468 · 109 años
Uranio
235 7,038 · 108 años
Radio
226 1.602 años
Cesio
137 30,07 años
Bismuto
207 31,55 años
Estroncio
90 28,90 años
Cobalto
60 5,271 años
Fuentes:
2.3.
Radioisótopos ligeros o inducidos
Por
último, hay átomos ligeros radiactivos. Estos radiosótopos
ligeros se producen en la Tierra por el efecto de la radiación
cósmica sobre los elementos más abundantes en ella (aquellos
anteriores al Hierro, Fe), por lo que se llaman radioisótopos
inducidos.
Entre
ellos, uno de los más interesantes es el Carbono-14, (14C)
que se forma en la alta atmósfera cuando la radiación cósmica
interactúa con el Nitrógeno-14 atmosférico (el Nitrógeno
forma el 70% de la atmósfera), primero por medio de la captura de un
neutrón y después por medio de un decaimiento beta.
A
medida que el 14C se desintegra, transformándose en
nitrógeno-14 (14N) se alcanza un estado de equilibrio
entre las velocidades de producción y la de desintegración, lo que
hace que la concentración de 14C en el CO2
atmosférico sea constante.
En
cada gramo de materia viva hay 14C suficiente como para
producir 16 desintegraciones por minuto. Al morir el organismo, se
deja de asimilar 14C y éste va decayendo lentamente a una
tasa conocida (más de 5.000 años de periodo de semidesintegración),
lo que permite datar con bastante precisión la edad de un fósil.
Los
radioisótopos inducidos más abundantes son:
Potasio-40
1,28 · 109 años
Calcio-41
1,03 · 105 años
Carbono-14
5.760 años
Oxígeno-15
122 segundos (se produce de forma continua)
Fuentes:
2.4.
Radioisótopos artificiales
La
tecnología de los reactores nucleares ha permitido al ser
humano fabricar isótopos que no están presentes de forma natural
en nuestro planeta (si alguna vez existieron, el largo tiempo
transcurrido desde la formación de nuestro planeta ha hecho que
prácticamente desapareciesen).
Así, elementos intensamente
radiactivos como el Neptunio (Np, Z=93, vida media de hasta 2
millones de años), el Plutonio (Pu, Z=94, vida media entre 30.000 y
80.000 años) Tecnecio (Tc, Z=43, vida media de hasta 4 millones de
años)...etc. han hecho su aparición en el medio ambiente por
primera vez en millones de años.
Se
trata de elementos con una vida media varios órdenes de magnitud
más corta que el Uranio y el Torio (hablamos de miles o millones
de años, frente a miles de millones) lo que quiere decir que las
descomposiciones son miles de veces más rápidas y, por tanto, son
miles de veces más radiactivos (y peligrosos) que ellos.
Las
consecuencias de tener con nosotros estos nuevos “compañeros de
viaje” son difíciles de prever, máxime cuando hablamos de unas
sustancias que van a estar acompañándonos (a nosotros o a quienes
nos sucedan) durante varios millones de años.
Neptunio
Plutonio
Tecnecio
Otros, como el cesio y el estroncio, son elementos que existen de forma natural, pero en los reactores nucleares se producen isótopos radiactivos (137Cs y 90Sr ) que tienen una vida media relativamente larga (entre 30 y 40 años) y son extremadamente radiactivos y peligrosos, ya que se absorben fácilmente por los seres vivos.
Cesio
Estroncio
Por
último, algunas especies de Yodo, (como el 131I)
aunque tengan una vida media muy corta, son rápidamente asimilados
por el organismo y se acumulan en la tiroides, donde causan daños.
Yodo
Fuentes:
3.
¿Cómo interacciona con la materia y qué efectos tiene sobre la
salud?
3.1.
Interacción con la materia
La
materia en estado ordinario se compone de átomos y
moléculas. Cada molécula es un conjunto de varios núcleos
atómicos (de carga positiva) que se mantienen cohesionados por una
“nube de electrones” (de carga negativa) a su alrededor.
Es
decir, los electrones son el “cemento” que mantiene unida a la
materia.
Si
se altera la relación entre electrones y carga de los núcleos,
puede llegar un momento en que la tensión electrostática entre los
núcleos que forman una molécula sea superior a la capacidad de
cementar de los electrones restantes. La molécula puede
desestabilizarse y romperse.
Por
tanto, la radiación ionizante, que altera la carga eléctrica
de la materia, tiene como uno de sus efectos secundarios la
desestabilización y rotura de las moléculas que la forman.
- Las partículas alfa, por su gran afinidad electrónica, capturan los electrones de la materia que atraviesan, alterando su carga.
- Las partículas beta+ (positrones) pueden aniquilar electrones de la nube, alternado la carga eléctrica de las moléculas.
- Las partículas beta- (electrones) de suficiente energía pueden:
- Ser absorbidas por un núcleo, alterando su carga eléctrica.
- O bien “chocar” con otros electrones transfiriéndoles parte de su energía cinética y arrastrándolos fuera de las moléculas.
- La radiación gamma interacciona con los átomos de la materia con tres mecanismos distintos.
- Absorción fotoeléctrica: interacción en la que el fotón gamma incidente desaparece y transfiere su energía a un electrón que sale “despedido” de la molécula. Los electrones tienen la capacidad de absorber energía en forma de cuantos de energía electromagnética (un “cuanto” de energía electromagnética no es más que un fotón de luz de una cierta longitud de onda) resultando en estados “excitados” de la molécula.
Si
la cantidad de energía absorbida es suficientemente alta, el
electrón sale “despedido” al exterior dejando a la molécula con
carga positiva (efecto fotoeléctrico).
El
efecto fotoeléctrico se da también con otras longitudes de onda
menos energéticas (rayos X y ultravioleta).
- Efecto Compton: colisión elástica entre un electrón ligado y un fotón incidente, con una transferencia de parte de la energía del fotón al electrón (la división de energía entre ambos depende del ángulo de dispersión).
- Producción de pares: el fotón desaparece y se forma un par electrón - positrón. Debido a que el positrón es una forma de antimateria, una vez que su energía cinética se haga despreciable se combinará con un electrón del material absorbente, aniquilándose y produciendo un par de fotones.
- Por último, los neutrones interaccionan con los núcleos de la materia mediante los siguientes efectos:
- Activación: interacción completamente inelástica de los neutrones con los núcleos, mediante la cual el neutrón es absorbido, produciendo un isótopo diferente (igual número Z e incremento de la masa A).
- Fisión: el neutrón se une a un núcleo pesado (como el 235U) excitándole de forma tal que provoca su inestabilidad y desintegración posterior en dos núcleos más ligeros y otras partículas. Es la base de los reactores nucleares de fisión.
- Colisión inelástica: el neutrón colisiona con el núcleo cediendo una parte de su energía, con lo que el resultado es un neutrón y un núcleo excitado que normalmente emite radiaciones gamma más tarde.
Fuentes:
3.2.
Medición del fenómeno: Unidades del SI
Las
unidades del Sistema Internacional para medir la radiación y sus
efectos sobre la salud son las siguientes:
- El Becquerel (Bq), que se define como la actividad de una cantidad de material radioactivo con decaimiento de un núcleo por segundo. Tradicionalmente, se ha usado también el Curio, que corresponde al número de descomposiciones por segundo del elemento Radio, y equivale a 3,7·1010 Bq, aunque resulta ser una unidad demasiado grande para las aplicaciones prácticas (el Radio es extremadamente radiactivo).
- El número de descomposiciones depende de la cantidad de sustancia radiactiva, por lo que suele usarse la unidad relativa Bq/Kg o Curio/Kg para medir la intensidad de la radiactividad de un material.
- Como hemos visto, no todas las descomposiciones nucleares corresponden al mismo fenómeno ni tienen asociadas las mismas características físicas y energéticas. Así, para tener en cuenta la intensidad energética de una radiación, se habla de Julios generados por kilo y segundo, J / Kg·s. La conversión se haría, para cada tipo de descomposición, multiplicando el número de descomposiciones por segundo (Bq) por la energía asociada a cada una de ellas.
- Normalmente, lo que interesa de la radiactividad es la cantidad de energía absorbida de forma acumulativa por un material expuesto.
El
Gray (Gy) es una unidad derivada del Sistema Internacional de
Unidades que mide la dosis absorbida de radiaciones ionizantes
por un determinado material. Un Gray es equivalente a la absorción
de un joule de energía ionizante por un kilogramo de material
irradiado. Así, 1 Gy = 1 J / Kg.
- La unidad para indicar la peligrosidad de una radiación para los seres vivos es una derivada del Gray, que tiene en cuenta los efectos de cada tipo de radiación sobre el material biológico (es una especie de media ponderada de las intensidades de cada tipo de radiación alfa, beta y gamma).
El
Sievert (símbolo Sv) es una unidad derivada del SI que mide
la dosis de radiación absorbida por la materia viva,
corregida por los posibles efectos biológicos producidos. 1 Sv
es equivalente a un julio absorbido por kilogramo J / kg.
La
diferencia con el Gray (unidad de la dosis absoluta absorbida)
es que el Sievert está multiplicado por un factor que pondera
para cada tipo de radiación el daño biológico que produce,
mientras que el Gray mide la energía absoluta absorbida por
un material.
El
Roentgen Equivalent Man (rem) es una unidad física
usada antiguamente, corresponde a la máxima dosis anual tolerable
por el organismo sin aumento apreciable del riesgo de cáncer, y
la equivalencia entre ambas es 1 Sv = 100 rem.
Fuentes:
3.3.
Dispositivos de medida
La medida de la radiación se lleva
a cabo por medio de varios dispositivos:
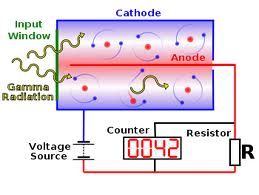
- Contador Geiger-Muller: es el dispositivo más sencillo, y permite contar el número de partículas cargadas eléctricamente (alfa y beta) que atraviesa un cilindro en el que se establece una diferencia de potencial eléctrico muy alta (de varios cientos o miles de voltios). Cada partícula cargada que lo atraviesa provoca una descarga o “avalancha” en cascada y una cuenta en el medidor. Es decir, sus unidades de medida son Becquerels.
Aplicando correcciones
estadísticas por tamaño y forma del tubo y distribución de tipo de
partículas se pueden establecer valores de energía y cantidad de
radiación recibida.
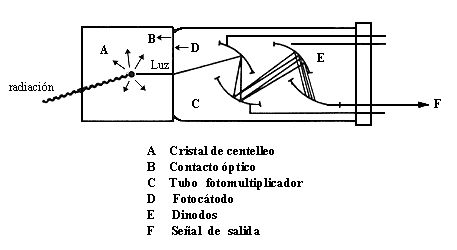
- Escintilador o centelleador: es un dispositivo que provoca un destello cada vez que una partícula cargada o un fotón de alta energía lo atraviesa, por ejemplo, un cristal de sulfuro de zinc. Estos destellos pueden ser detectados por elementos fotosensibles y fotomultiplicadores y contabilizados.
Fuentes:
3.4.
Efectos sobre la salud
Los
seres vivos están formados por moléculas grandes y
complejas, como las proteínas y el ADN. La radiación puede
alterar estas complejas estructuras, y si afecta al ADN, provocar
daños permanentes y hereditarios.
Nuevo
símbolo ISO para señalizar la presencia de fuentes de radiación
ionizante, con una advertencia más explícita de los riesgos que
comporta.
Las
proteínas se están generando continuamente, por lo que los
daños sobre las mismas no tienen implicaciones graves (a no ser que
sean masivos). Es más peligroso que los daños afecten al ADN.
 |
| Una secuencia de ADN |
La
vida lleva millones de años conviviendo con la radiación de baja
intensidad, por lo que ha desarrollado mecanismos para protegerse
frente a pequeños daños en el ADN.
La
molécula de ADN es doble (es decir, hay una copia de seguridad) y
toda una legión de proteínas especializadas se encarga de
reparar los daños que eventualmente se produzcan.
Sin embargo, hay tres situaciones en
las que el daño puede ser permanente:
- Si el ADN dañado está en medio de un proceso de secuenciación (como ocurre, por ejemplo, en células en proceso de división o “mitosis”) y la doble hélice está “desenrollada”: en este caso, si se daña una porción fuera de la doble hélice, la proteína encargada de las reparaciones no va a tener una copia de seguridad.
- O bien el daño es tan masivo que se pierde la posibilidad de restaurar la situación original (estas situaciones suelen desencadenar la muerte programada o “apoptosis” de la célula).
- O bien si afecta a una célula reproductora.
La
ley de la radiosensibilidad (también conocida como ley de Bergonié
y Tribondeau, postulada empíricamente en 1.906 y demostrada más
adelante) establece que los tejidos y órganos más sensibles a
las radiaciones son los menos diferenciados y los que
exhiben alta actividad reproductiva (alta tasa de renovación).
Como
ejemplo, tenemos:
- Tejidos altamente radiosensibles: epiteliales (mucosa intestinal, piel, pulmones...etc), órganos reproductivos (ovarios, testículos), médula ósea, glándula tiroides.
- Tejidos medianamente radiosensibles: tejido conectivo.
- Tejidos poco radiosensibles: neuronas, hueso.
Por el mismo motivo:
- Los embriones, bebés y niños en fase de crecimiento son más sensibles que los adultos.
- Las mujeres, con unos pocos centenares de células reproductoras, son mucho más sensibles que los hombres, que producen millones de células reproductoras cada día.
- A igual dosis, una radiación de baja intensidad y largo tiempo es mejor tolerada que una de alta intensidad y breve duración.
Los daños producidos son los
derivados de la destrucción de las moléculas y, principalmente, el
ADN:
- Necrosis y degeneración de tejidos.
- Mutaciones que pueden ser hereditarias
- Cáncer de diversos tipos
- En caso de exposición intensa, quemaduras y heridas que no curan (por destrucción del tejido que debe reparar la herida)
Las
radiaciones naturales (emitidas por el medio ambiente) son, en
principio, inofensivas (aunque se cree que tienen una función
importante en la evolución de la vida, provocando mutaciones
expontaneas).
El
promedio de tasa de dosis equivalente medida a nivel del mar es de
0,12 microsievert por hora (1,2 microrem por hora).
La dosis efectiva (suma de las
dosis recibida desde el exterior del cuerpo y desde su interior) que
se considera que empieza a producir efectos en el organismo de forma
detectable es de 100 mSv (10 rem) en un periodo de 1 año.
Hay
que tener en cuenta que el Sievert y el rem son unidades de
exposición acumulativa, es decir, guardan la historia de la
exposición a las diferentes fuentes de radiación a lo largo de la
vida del ser vivo.
Por
tanto, el factor que hay que tener en cuenta para evaluar el impacto
en la salud es la exposición acumulada, y no tanto la
puntual.
Por
este motivo, el personal expuesto por razones profesionales
o ambientales a este tipo de radiación debe llevar consigo un
dosímetro, que es un aparato que mide la exposición
acumulada, y se deben tomar medidas preventivas (alejamiento,
apantallamiento adicional...etc.) si se alcanzan las dosis máximas
recomendables:
Fuentes:
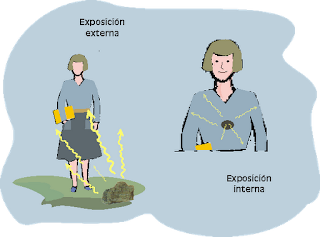
3.4.
Radiación interna y externa
A
la hora de evaluar el impacto sobre la salud, es muy importante
distinguir si la fuente de radiación es externa o interna.
- De la radiación externa, la alfa y beta es frenada por la piel y sólo penetra la radiación gamma. Pueden prevenirse los daños reduciendo del tiempo de exposición, alejándose de la fuente (la intensidad disminuye con el cuadrado de la distancia):
o
interponiendo pantallas, preferiblemente de materiales de alta
densidad (para la radiación gamma, a modo de ejemplo, 6 mm de plomo
realizan la misma labor aislante que 1 m de hormigón o 6 m de
tierra).
Los
efectos de la radiación externa dependen de la dosis acumulada:
- De la interna, mucho más peligrosa, afectan los tres tipos y especialmente la radiación alfa y beta, muy energética, produce daños e inflamación locales.
Las fuentes de entrada de
material radiactivo son: la ingestión, inhalación, y la
penetración por contacto a través de heridas o piel sana.
La
radiación interna es provocada por una serie de isótopos muy
concretos, (verdaderas “bestias negras”) cuyo efecto depende
de su comportamiento y el lugar en que se acumulan:
Yodo (131I)
Presente en: agua contaminada (normalmente, tras un vertido de agua contaminada en una central o una explosión)
Se adquiere a través de: agua y alimentos
Presencia en el organismo: breve (unos días)
Se acumula en: tiroides
Causa: tiene el potencial de causar mutaciones cancerosas en la tiroides
- Cesio (137Cs)
- Presente en: agua contaminada y alimentos, donde es muy soluble, debido a que químicamente se comporta como el sodio o el potasio
- Se adquiere a través de: agua y alimentos
- Presencia en el organismo: Unos 50 días de media
- Se acumula en: músculos y zonas blandas
- Causa: cánceres del tejido blando, mutaciones
- Metales pesados (Uranio U, Torio Th, Neptunio Np, Plutonio Pu, Actinio Ac, Americio Am...etc.)
- Presente en: terrenos contaminados, aire
- Se adquiere a través de: no es común entrar en contacto con estas sustancias, toda vez que sólo existen en cantidades apreciables en instalaciones nucleares y militares: si hay vertidos, escapes o explosiones, pueden contaminar los alimentos y el aire (por tanto, una fuente posible de contaminación es respirar el polvo contaminado tras un accidente o vertido). Aunque, como metales, pueden formar sales solubles en agua, su absorción intestinal es lenta y las contaminaciones en humanos suelen provenir del polvo fino producido en explosiones y accidentes de instalaciones nucleares
- Presencia en el organismo: permanente
- Se acumula en: pulmones, hígado y riñón
- Causa: irritación crónica de los pulmones y las cavidades en las que se deposita, varios tipos de cáncer
- Radio (Ra), Calcio (41Ca) y Estroncio (90Sr)
- Presente en: agua, pastos y alimentos (especialmente productos lácteos de ganado contaminado)
- Se adquiere a través de: agua y alimentos
- Presencia en el organismo: permanente
- Se acumula en: tejido óseo, donde se asimilan muy fácilmente como el calcio, por ser químicamente muy similares
- Causa: leucemias, degeneración del tejido óseo (es famoso el caso del Radithor http://thales.cica.es/rd/Recursos/rd99/ed99-0504-01/radio.html ), cáncer de huesos
- Radon (Rn)
- Presente en: suelos volcánicos (graníticos), con presencia de mineral de uranio
- Se adquiere a través de: aire respirado y agua
- Presencia en el organismo: breve, por tener un periodo de descomposición muy corto
- Se acumula en: no se acumula
- Causa: cáncer de pulmón y mutaciones
- Polonio (Po)
- Presente en: fertilizantes de fosfatos provenientes de zonas ricas en mineral de uranio (la mayoría, por desgracia), ya que es un subproducto de la descomposición del mismo
- Se adquiere a través de: humo del tabaco, verdura y vegetales contaminados
- Presencia en el organismo: permanente (se asimila al azufre)
- Se acumula en: pulmones de fumadores, hígado y riñón
- Causa: cáncer, leucemia y mutaciones
Adicionalmente,
tenemos dos isótopos radiuactivos presentes de forma natural en los
seres vivos:
- Potasio (40K)
- Presente en: de forma natural en el suelo en diversas concentraciones.
- Se adquiere a través de: alimentos y agua
- Presencia en el organismo: un 1% del potasio del organismo (unos 0,5 g) es radiactivo
- Se acumula en: todo el organismo
- Causa: potenciales mutaciones
- Carbono (14C)
- Presente en: atmósfera
- Se adquiere a través de: alimentación
- Presencia en el organismo: constante
- Se acumula en: todo el organismo
- Causa: mutaciones esporádicas
Referencias:









































First !
ResponderEliminarEspero no sea offtopic ...En inglés y en Español una bonita reflexión ..
ResponderEliminarInglés :
"What is the only provocation that could bring about the use of nuclear weapons? Nuclear weapons. What is the priority target for nuclear weapons? Nuclear weapons. What is the only established defense against nuclear weapons? Nuclear weapons. How do we prevent the use of nuclear weapons? By threatening the use of nuclear weapons. And we can't get rid of nuclear weapons, because of nuclear weapons. The intransigence, it seems, is a function of the weapons themselves."
Martin Amis, Einstein's Monsters (1987), "Introduction: Thinkability"
Spanish :
¿Cuál es la única provocación que motive el uso de armas nucleares ? Las armas nucleares. ¿Cuál es el objetivo de las armas nucleares ? Armas nucleares. ¿Cuál es la única defensa establecida contra las armas nuecleares ? Armas nucleares. ¿Cómo prevenimos el uso de armas nucleares ? Lidiando con armas nucleares.
y no nos podemos librar de las armas nucleares por las armas nucleares. La intransigencia parece que es una función propia de las armas nucleares.
Saludos !
(soy Luis) El principal argumento contra las centrales y las armas de este tipo es que están produciendo especies nuevas, miles de veces más activas que las naturales, en grandes cantidades y con vidas medias que superan en miles de veces la durabilidad de las construcciones humanas más antiguas. Muchas seguirán ahí cuando ya no existan los seres humanos.
EliminarLo que se dice, un artículo muy currado. Felicitaciones por tu esfuerzo Luis Cosin !!
ResponderEliminar(leerlo completo, entenderlo y asimilarlo me tomará un buen rato)
Muy interesante, Luis.
ResponderEliminarTan sólo me gustaría comentar una cuestión, la de las dosis mínimas establecidas. Es un tema controvertido en el que parece no haber acuerdo. Los datos que incluyes, si no me equivoco, son los reconocidos por la OMS ¿verdad?
Es interesante tirar del hilo hacia arriba para ver con qué criterios se establecieron esas dosis mínimas "seguras" que algunos miramos con total desconfianza. Siento no poder aportarte citas o enlaces concretos, porque por un problema que tuve con el ordenador perdí todo hace unos meses, pero creo que es algo realmente importante y que definirá el que consideremos creíbles los datos sobre peligrosidad o inocuidad de lo que se escapa de Fukushima, Chernóbil o las centrales que tenemos al lado de casa.
De entrada yo siempre recomiendo esto
http://www.ratical.org/radiation/inetSeries/nwJWG.html
y esto http://www.euradcom.org/
Gracias por el artículo Luis, y gracias por el blog, Antonio.
La peligrosidad de pequeñas dosis es un asunto que se questiona a menudo: los efectos no son nada inmediatos y aparecen a medio y largo plazo.
EliminarLa teoria mas comunmente acceptada es de la relación linear dosis-efectos, y sin umbral por debajo de cual la dosis dejaría de ser peligrosa.
La credibilidad de la OMS en materia nuclear es bastante dudosa debido al acuerdo que tiene con la OIEA (organismo de promoción de la energia nuclear): ver http://es.wikipedia.org/wiki/Acuerdo_WHA12-40_entre_la_OIEA_y_la_OMS_de_1959
(Soy Luis) Muchas gracias por el interés. El tema es muy actual y merece una explicación suficientemente detallada entre tanta intoxicación informativa. Las dosis a las que me refiero diciendo que no existen "efectos apreciables", efectivamente son las que la OMS maneja. Pero, (y es un gran "pero") hay que tener en cuenta que estos valores son para radiación "externa". La radiación "interna" es mucho más dañina y peligrosa a dosis que son prácticamente indetectables.
EliminarUn articulo muy completo, y scientifico, que no entra en la polemica de los efectos de las radiaciónes de baja intensidad.
ResponderEliminarSin embargo, en relación con los riesgos de la energia nuclear, me gustaria enfatizar que el mayor problema esta relacionado con la irradiación interna, es decir la contaminación radiactiva.
Este riesgo peculiar suele ser minimizado por los promotores de este tipo de energia (o ni siquiera lo tienen en cuenta cuando comparan la exposición resultante de un accidente nuclear -externa, no lo dicen- con un viaje en avión por ej. ).
Y lo tienen fácil:
No solamente los efectos nefastos se suelen producir unos cuantos años más tarde y por eso son difíciles de relacionar con la contaminación radiactiva, pero también es muy difícil medir esta contaminación: ¿ como detectar un emisor beta o alfa, de los más peligrosos, cuando se ha incorporado de forma permanente al cuerpo ?
(soy Luis) Aunque la radiación interna es indudablemente mucho más peligrosa incluso a niveles indetectables, hay que tener en cuenta que el carbono 14 y el potasio 40 son fuentes de radiación que existen en cantidades apreciables dentro de nuestro organismo. De hecho, se cree que son resposables de buena parte de las mutaciones expontáneas que permiten la evolución de los seres vivos. Otra cosa es tener en el cuerpo cantidades apreciables de Radio o Cesio, como le ocurrió a las pintoras de esferas de reloj fosforescentes o a los consumidores del infausto medicamento milagro Radithor: http://www.alpoma.net/tecob/?p=532
EliminarHay una diferencia muy importante entre el C14 y el K40, de hecho el K40 es el isotopo radioactivo(*) más abundante en el organismo, y es muy abundante en un plátano, por ejemplo -tanto que hasta hay una unidad-banana !
EliminarLa diferencia es que el C14 se encuentra en enlace covalente, y el K40 en enlace iónico, esto es importantísimo.
Cuando el C14, que es un emisor beta, se descompone el "shock" lo arranca de la molécula, y en todo caso aún si continúa, al transformarse en Nitrógeno si fuera una base de ADN es un cambio que provoca una mutación. Cierto que hay enzimas que recorren continuamente el ADN eliminando estos cambios indeseables, pero tienen una cierta tasa de error.
Cada ciertos millones habrá un cambio que puede tener graves consecuencias. Esto es el riesgo, más que la radiactividad en si.
En cambio el K40 es un emisor gamma y generalmente disuelto en el plasma o en enlace iónico con sales o ácidos débiles. Al emitir su radiación es poco probable un daño serio.
Linus Pauling obtuvo su 2do Premio Nobel precisamente por haber explicado estos hechos al Senado Americano y lograr detener las pruebas atómicas en la atmósfera, que llenaban el aire con C14. Cuando les explicó que todos ellos y su familia iban a morir de cáncer se les concentró la mente en seguida.
Por cierto, el profesor de bioquímica Isaac Asimov lo había explicado algunos años antes, y rabiaba de que le dieron el Nobel a Pauling y no a él, lo publicó en un artículo que tuve pero lo he perdido.
----------------
(*) Prefiero la expresión Radioactividad, manque la Academia, porque en los idiomas de cultura de las naciones que investigaron esta fuerza de la materia se dice Radioactivité, Radioactivity, y Radioaktivität (francés, inglés y alemán respectivamente)
Puesto que España no contribuyó con nada en absoluto a estas investigaciones, el capricho de llamarlo Radiactividad es uno de tantos errores, puedo nombrar muchos más de este idioma y cultura de tercera división, son incapaces hasta de darle el nombre correcto a las cosas.
Este comentario ha sido eliminado por el autor.
EliminarSólo espero que un alma caritativa sea capaz de resumir este a todas luces interesante artículo, no es que no le de importancia, pero es que mis días son de 24 horas¡¡ lo siento mucho, nunca creo que pueda leerlo, por favor, un resumen¡¡¡¡¡¡
ResponderEliminarEn mi opinión no hay mucho que resumir. El artículo revisa diferentes aspectos del tema que son distintos. La información va al grano en todo momento, hay poco que se pueda llamar anecdótico. Resumir sería eliminar. Y además, nadie aquí a alargado la explicación con intenciones egoístas (lo digo por lo de alma caritativa).
EliminarA mí me resulta algo doloroso cuando trato de explicar un tema complejo siendo lo más conciso posible, con todo el esfuerzo intelectual que eso supone (no sólo has de entender la cuestión desde tu perspectiva sino que también has de entender los procesos mentales de los demás para acertar con las teclas adecuadas). Y entonces me piden que resuma para que se entienda. Resulta doblemente paradójico, porque ya está resumido y porque para entender más hace falta leer más o hacer más preguntas.
Caritativo (para con nuestro conocimiento) es el que te suelta un artículo como el de Luis Cosin. Gracias.
Y por eso se construyen los sitios dónde vayas a tener radioactividad lejos de la gente... a no ser que seas Kodak, claro
ResponderEliminarhttp://gizmodo.com/5909961/kodak-had-a-secret-weapons+grade-nuclear-reactor-hidden-in-a-basement
quilo y medio de uranio al 20%... casi nada
(soy Luis) No hace falta irse a Nueva York, porque aquí también los hemos tenido, y han provocado accidentes y fugas http://palestradigital.wordpress.com/2011/03/18/ciudad-universitaria-madrid-1970-el-accidente-nuclear-que-franco-silencio/
EliminarEs la mayor "españolada" de la que jamás he tenido noticia. Les da por poner un reactor nuclear, sin tener idea exacta de cómo montarlo, en la poblada capital del imperio.
Eliminar¡Y en 2007 todavía estaba el reactor en el CIEMAT!
Ni Alfredo Landa.
[, como reconoció la JEN en su informe confidencial del 18 de noviembre. "Ni el jefe de la Sección de Combustibles irradiados, ni el jefe del Grupo de Operación de la Planta M-1 ni el jefe del Grupo de Residuos conocían la reglamentación en materia de seguridad nuclear", afirma el informe.]
EliminarVamos, que en el Madriz de Don Paco, al igual que salen oficiales de la marina que en su vida han visto un barco, construyen reactores nucleares o juegan al Tute.
Y eghhh que epanha va mu bien.... una grande y libre y esas cosas.... y así in eternum....
EliminarGracias por la info Luís! Lo que me faltaba por saber, me da la impresión que soy el único que tiene miedo de los materiales radiactivos o que?
Eliminar(soy Luis) Me han pasado este enlace sobre lo que ocurrió en Vandellós I. Definitivamente, estuvimos muy, muy cerca de Fukushima. Y eso que nos avisaron con años de antelación (en Francia hay una central gemela que años antes sufrió una gran reforma para solventar sus problemas de seguridad, reforma que la española no sufrió) http://www.greenpeace.org/espana/es/news/091019/
Eliminarhttp://elpais.com/diario/1989/10/22/espana/625014008_850215.html
EliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarMuy bien, Álvaro. Ahora explícame 1) que tiene que ver eso con lo que se discute hoy aquí y 2) en qué nuestra posición es tan diferente de la tuya.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarMuy buen artículo y muy bien explicado.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarEste comentario ha sido eliminado por el autor.
Eliminarvendrá crosscountry y nos dirá que para lo que nos interesa bien que se multiplican los panes y los peces sin que nadie proteste...
Eliminarhombre de poca fe ¬_¬
(soy Luis) Efectivamente, hay un error de escala. Gracias por la corrección!
Eliminarhttp://www.pakalertpress.com/2012/05/13/plume-gate-secret-documents-prove-global-cover-up-of-continued-fukushima-radiation-pollution/
ResponderEliminarEsto me lo ha enviado el colega Casdeiro, señores los efectos de la radioactividad se anulan con fascismo, facil.
Tema off-topic: recomiendo la viñeta de hoy de El Roto en El País, apoteósica para los lectores peakoilers del blog!!!
ResponderEliminarhttp://elpais.com/elpais/2012/05/15/vinetas/1337096774_808548.html
a mi la que me da miedo es esta otra....... http://www.ara.cat/economia/Aznar-se-sortir-crisi_0_701329975.html
EliminarUn offtopic de plena actualidad.
ResponderEliminarPalabras desde Atenas:
http://desdemicornijal.blogspot.com.es/2011/10/palabras-desde-atenas-globalizar-la.html
¿Lo vamos a permitir?
ResponderEliminarhttp://desgobierno.wordpress.com/2012/05/17/troika-exige-socializar-perdidas/
Juan Carlos
Hijos de puta...
Eliminar